Этиленгликоль растворимость в воде
Этиленгликоль
В промышленности этиленгликоль получают гидратацией этиленоксида в присутствии серной или ортофосфорной кислоты. В качестве побочных продуктов образуются ди-, три- и полигликоли.
Выпускают этиленгликоль двух марок: волоконный и антифризный.
 Этиленгликоль применяют в химической, текстильной, автомобильной, авиационной, электротехнической промышленностях. Он обладает уникальной возможностью не замерзать при пониженных температурах. Исключительно важным свойством этиленгликоля является его способность понижать температуру замерзания водных растворов. Благодаря этому, вещество нашло широкое применение в производстве низкозамерзающих и охлаждающих жидкостей (автомобильных антифризов, тосолов, тормозных жидкостей).
Этиленгликоль применяют в химической, текстильной, автомобильной, авиационной, электротехнической промышленностях. Он обладает уникальной возможностью не замерзать при пониженных температурах. Исключительно важным свойством этиленгликоля является его способность понижать температуру замерзания водных растворов. Благодаря этому, вещество нашло широкое применение в производстве низкозамерзающих и охлаждающих жидкостей (автомобильных антифризов, тосолов, тормозных жидкостей).
Кроме того, 41-45% мирового производства этиленгликоля используется для получения синтетических полиэфирных волокон и пленок: целлофана, полиуретанов и ряда других полимеров.
Также моноэтиленгликоль применяют при производстве гидравлических и закалочных жидкостей, алкидных смол, растворителей, конденсаторов, крема для обуви, взрывчатого вещества нитрогликоля и для других целей.
Физико-химические характеристики моноэтиленгликоля ГОСТ 19710-83:


Упаковка, транспортировка и хранение.
Этиленгликоль заливают в алюминиевые бочки вместимостью 110 и 275 дм³, бочки из коррозионно-стойкой стали вместимостью 110-250 дм³, в стальные неоцинкованные бочки вместимостью 100, 200 дм³, а также в железнодорожные цистерны с котлами из алюминия или коррозионно-стойкой стали.
Этиленгликоль, упакованный в бочки, транспортируют всеми видами транспорта в крытых транспортных средствах, а также наливом в железнодорожных цистернах в соответствии с правилами перевозок грузов, действующими на данном виде транспорта. Этиленгликоль, упакованный в бочки, перевозят железнодорожным транспортом повагонно и мелкими отправками. При транспортировании наливом – в железнодорожных цистернах с котлами из алюминия или коррозионно-стойкой стали, по согласованию с потребителем – в железнодорожных цистернах с верхним сливом и цистернах из углеродистой стали.
Этиленгликоль хранят в герметичных емкостях из алюминия, коррозионно-стойкой стали или алюминированной стали. Этиленгликоль в бочках хранят в крытых неотапливаемых складских помещениях. Не допускается хранение продукта высшего сорта в бочках из углеродистой стали. Бочки с этиленгликолем должны храниться вертикально. Высота штабеля бочек не должна превышать три яруса.
Гарантийный срок хранения: высшего сорта – 1 год со дня изготовления, первого сорта – 3 года со дня изготовления.
ООО “Компани “Плазма”® осуществляет поставки химической продукции со склада в Харькове в сроки и по доступным ценам, на выгодных для Вас условиях.
ЭТИЛЕНГЛИКОЛЬ
ЭТИЛЕНГЛИКОЛЬ (1,2-этандиол) НОСН2СН2ОН, мол. м. 62,07; бесцв. вязкая гигроскопич. жидкость без запаха, сладковатого вкуса; т. пл.-12,7 °С, т. кип. 197,6 °С, 100°С/16 мм рт. ст.; 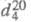 1,1088;
1,1088;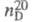 1,4316;
1,4316; 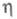 19,83 мПа х с (20 °С);
19,83 мПа х с (20 °С); 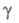 48,4 мН/м (20 °С);
48,4 мН/м (20 °С); 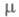 7,3 х 10 -30 Кл-м (30 °С); х ур-ние температурной зависимости давления пара в интервале 25-90 °С: lgp (мм рт. ст.) = 8,863 – 2694,7/t;
7,3 х 10 -30 Кл-м (30 °С); х ур-ние температурной зависимости давления пара в интервале 25-90 °С: lgp (мм рт. ст.) = 8,863 – 2694,7/t; 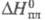 11,64 Дж/моль;
11,64 Дж/моль; 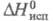 58,71 Дж/моль;
58,71 Дж/моль; 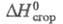 жидкости -1180,3 Дж/моль (20 °С);
жидкости -1180,3 Дж/моль (20 °С); 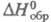 газа -397,75 кДж/моль; теплопроводность 0,29 Вт/(м х град), электропроводность 1,07 х 10 -6 См х см -1 ,
газа -397,75 кДж/моль; теплопроводность 0,29 Вт/(м х град), электропроводность 1,07 х 10 -6 См х см -1 , 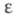 38,66 (20 °С). Хорошо раств. в воде, спиртах, кетонах и др., умеренно – в бензоле, толуоле, диэтиловом эфире, ССl4. В этиленгликоле плохо раств. растит. и животные масла и не раств. минер. масла, парафины, каучук, ацетил- и этил-целлюлоза, поливинилхлорид.
38,66 (20 °С). Хорошо раств. в воде, спиртах, кетонах и др., умеренно – в бензоле, толуоле, диэтиловом эфире, ССl4. В этиленгликоле плохо раств. растит. и животные масла и не раств. минер. масла, парафины, каучук, ацетил- и этил-целлюлоза, поливинилхлорид.
При растворении этиленгликоля в воде выделяется теплота и происходит уменьшение объема. Водные р-ры замерзают при низких т-рах:
Концентрация этиленгликоля , % по объему 20 30 40 50 66,7 80 90 Т-ра замерзания, °С -8 -15 -24 -36 -75 -47 -29. Этиленгликоль обладает всеми св-вами гликолей. С щелочными металлами и щелочами образует гликоляты, с орг. к-тами или их ангидридами – одно- и двухзамещенные сложные эфиры, с HHal – этиленгалогенгидрины НОСН2СН2На1, с РС15 – дихлорэтан С1СН2СН2С1, с акрилонитрилом – моно- и ди(2-цианоэтиловые) эфиры этиленгликоля, соотв. HOCH2CH2OCH2CH2CN и [CH2(OCH2CH2CN)]2, при дегидратации – ацетальдегид (в присут. ZnCl2), диэтиленгликоль (в присут. NaOH) или диоксан (при нагр. в присут. H2SO4), с этиленоксидом – полиэтиленгликоли Н(ОСН2СН2)nОН. При окислении этиленгликоля в зависимости от условий и окислителя образуется смесь гликолевого альдегида НОСН2СНО, гликолевой к-ты НОСН2СООН, глиоксаля ОНССНО, глиоксалевой к-ты ОНССООН и щавелевой к-ты; окисление мол. кислородом приводит к пероксидам, формальдегиду, муравьиной к-те. КМnО4 и К2Сr2О7 окисляют этиленгликоль до СО2 и Н2О.
С1СН2СН2С1 + Na2CO3 + Н2О НОСН2СН2ОН + 2NaCl + СО2
НОСН2СН2ОН + 2NaCl + СО2
. Этиленгликоль может быть получен взаимод. этиленоксида с СО2 при т-ре 80-120 °С и давлении 2-5 МПа в присут. галогенидов щелочных металлов, аммония или аминов с послед. гидратацией образующегося этиленкарбоната:
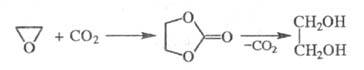
Этот метод позволяет использовать водный р-р этиленоксида (1:1), выход 97-98%.
Э тиленгликоль образуется также при ацетоксилировании этилена с послед. гидролизом моно- и диацетатов этиленгликоля (кат.- хлориды Pd, Li, нитраты Fe, Ni); недостаток метода – высокая коррозионность среды, трудность отделения солей и продуктов р-ции, необходимость регенерации катализатора.
При уменьшении добычи нефти и резком увеличении стоимости этилена представляют интерес методы синтеза этиленгликоля из альтернативного сырья: синтез-газа, метанола, СО и воды при т-ре 200 °С и давлении 70 МПа либо в жидкой фазе при 40 МПа в присут. оксидных медно-магниевых или родиевых катализаторов; из СО и Н2 – через диэфиры щавелевой к-ты.
Э тиленгликоль применяют в хим., текстильной, автомобильной, авиационной, электротехн. пром-сти; 41-45% мирового произ-ва этиленгликоля используется для получения синтетич. полиэфирных волокон и пленок,
40% – в произ-ве антифризов. Этиленгликоль применяют также в произ-ве гидравлич. и закалочных жидкостей, полиуретанов, алкидных смол и др.
Э тиленгликоль токсичен при попадании внутрь, действует на центр. нервную систему и почки; смертельная доза 1,4 г/кг. ПДК в воздухе рабочей зоны 5 мг/м 3 .
Э тиленгликоль- горючая жидкость. Т. всп. в открытом тигле 120 °С, т. самовоспл. 380 °С, КПВ в воздухе: нижний 3,8, верхний 6,4% (по объему). Температурные пределы воспламенения: нижний 112 °С, верхний 124 °С.
Мировое потребление этиленгликоля
Физические свойства этиленгликоля C2H4(OH)2 — водный раствор (антифриз)

Физические свойства водного раствора этиленгликоля
В таблице представлены следующие теплофизические и физические свойства этиленгликоля в виде водного раствора различной концентрации ζ: плотность ρ, температура замерзания tз, теплоемкость C, динамическая вязкость μ, кинематическая вязкость ν, теплопроводность λ, температуропроводность a, число Прандтля Pr этиленгликоля.
Физические свойства раствора этиленгликоля приведены в таблице в зависимости от температуры и его концентрации в растворе.
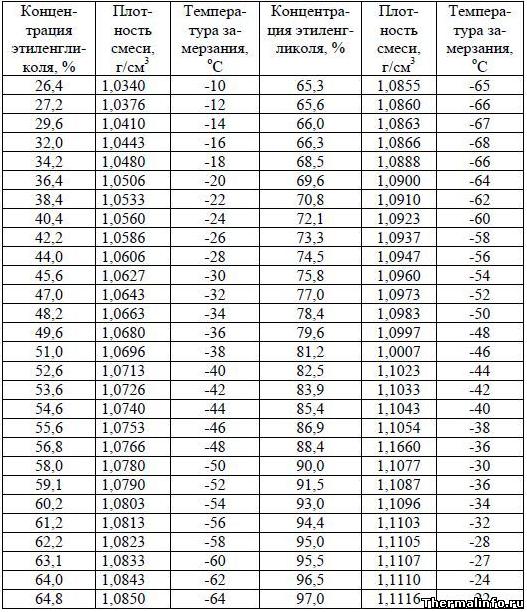
По данным таблицы видно, что с увеличением концентрации этиленгликоля в растворе его теплоемкость и теплопроводность уменьшаются, а температура замерзания раствора снижается при концентрации этиленгликоля до 66,3%. При дальнейшем увеличении концентрации этиленгликоля, температура замерзания раствора начинает повышаться.
В случаях применения раствора этиленгликоля в качестве антифриза в системе охлаждения автомобиля, снижение величин этих физических свойств этиленгликоля приведет к меньшему теплоотводу от двигателя. Таким образом, чем более концентрированный раствор этиленгликоля применяется в качестве охлаждающей жидкости, тем менее эффективно будет работать система охлаждения автомобиля в части отвода тепла от двигателя.
Физические свойства этиленгликоля даны в диапазоне температуры от минус 30 до 50°С и при концентрации этиленгликоля в растворе от 4,6 до 46,4 %.
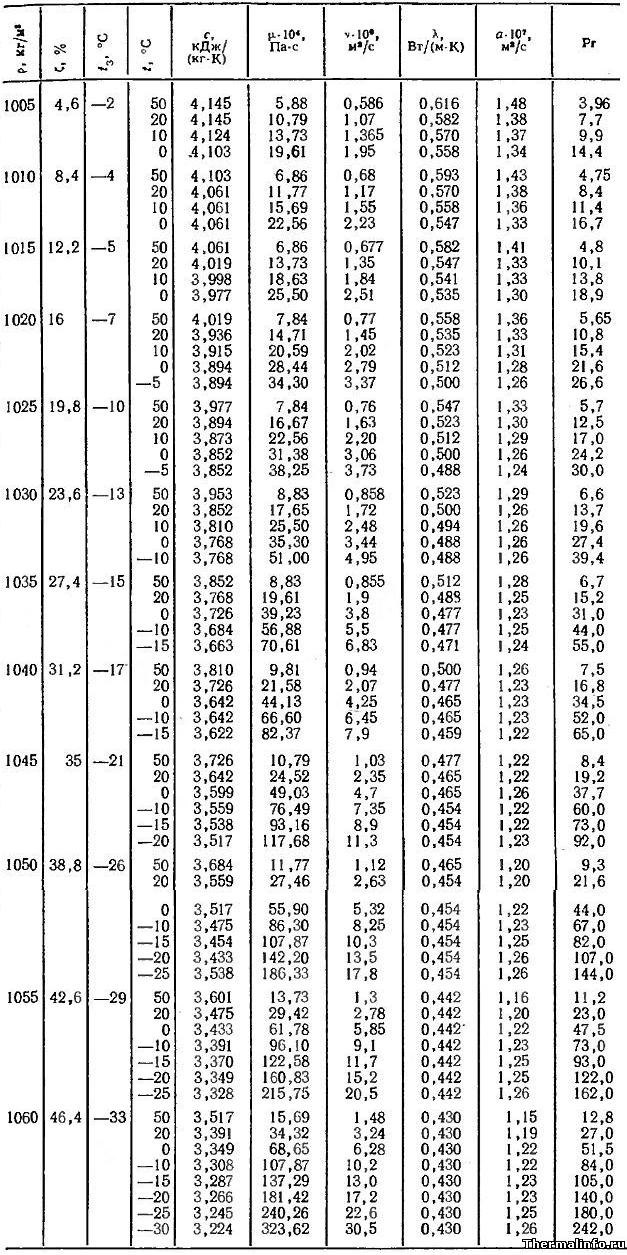
Плотность и температура замерзания раствора этиленгликоля
В таблице даны значения плотности и температуры замерзания смеси технического этиленгликоля и воды в зависимости от концентрации. Следует отметить, что с увеличением содержания этиленгликоля в растворе, увеличивается плотность раствора. Температура замерзания раствора этиленгликоля при увеличении его концентрации в растворе снижается (до содержания этиленгликоля 66,3%), а затем начинает расти.
Таким образом, раствор этиленгликоля обладает свойством не замерзать до температуры -68°С при концентрации этиленгликоля в растворе 66,3%. Такие свойства раствора этиленгликоля в воде позволяют применять его в качестве антифриза во множестве систем.
 Источники:
Источники:
- Данилова Г.Н. и др. Сборник задач по процессам теплообмена в пищевой и холодильной промышленности. М.: «Пищевая промышленность» 1976.- 240 с.
- Лиханов В.А., Лопатин О.П. Технические жидкости: Учебное пособие. – Киров: Вятская ГСХА, 2005. – 43 с.
главная > справочник > химическая энциклопедия:
Этиленгликоль (1,2-этандиол) НОСН2СН2ОН, молекулярная масса 62,07; бесцветная вязкая гигроскопическая жидкость без запаха, сладковатого вкуса; т. пл.-12,7 °С, т. кип. 197,6 °С, 100°С/16 мм рт. ст.; 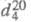 1,1088;
1,1088; 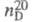 1,4316;
1,4316; 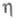 19,83 мПа х с (20 °С);
19,83 мПа х с (20 °С);  48,4 мН/м (20 °С);
48,4 мН/м (20 °С); 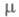 7,3 х 10 -30 Кл-м (30 °С); х уравнение температурной зависимости давления пара в интервале 25-90 °С: lgp (мм рт. ст.) = 8,863 – 2694,7/t;
7,3 х 10 -30 Кл-м (30 °С); х уравнение температурной зависимости давления пара в интервале 25-90 °С: lgp (мм рт. ст.) = 8,863 – 2694,7/t;  11,64 Дж/моль;
11,64 Дж/моль; 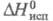 58,71 Дж/моль;
58,71 Дж/моль;  жидкости -1180,3 Дж/моль (20 °С);
жидкости -1180,3 Дж/моль (20 °С);  газа -397,75 кДж/моль; теплопроводность 0,29 Вт/(м х град), электропроводность 1,07 х 10 -6 См х см -1 ,
газа -397,75 кДж/моль; теплопроводность 0,29 Вт/(м х град), электропроводность 1,07 х 10 -6 См х см -1 ,  38,66 (20 °С).
38,66 (20 °С).
Хорошо растворим в воде, спиртах, кетонах и других, умеренно – в бензоле, толуоле, диэтиловом эфире, ССl4. В этиленгликоле плохо растворяются растительные и животные масла и не растворимы минеральные масла, парафины. каучук, ацетил-и этил-целлюлоза, поливинилхлорид.
При растворении этиленгликоля в воде выделяется теплота и происходит уменьшение объема. Водные растворы замерзают при низких температурах:
Концентрация этиленгликоль, % по объему 20 30 40 50 66,7 80 90 Температура замерзания, °С -8 -15 -24 -36 -75 -47 -29.
Этиленгликоль обладает всеми свойствами гликолей. С щелочными металлами и щелочами образует гликоляты, с органическими кислотами или их ангидридами – одно- и двухзамещенные сложные эфиры. с HHal – этиленгалогенгидрины НОСН2СН2Наl, с РСl5 – дихлорэтан СlСН2СН2С1, с акрилонитрилом – моно- и ди(2-цианоэтиловые) эфиры этиленгликоля, соответственно HOCH2CH2OCH2CH2CN и [CH2(OCH2CH2CN)]2, при дегидратации – ацетальдегид или диоксан (при нагревании в присутствии H2SO4), с этиленоксидом – полиэтиленгликоли Н(ОСН2СН2)nОН.
При окислении этиленгликоля в зависимости от условий и окислителя образуется смесь гликолевого альдегида НОСН2СНО, гликолевой кислоты НОСН2СООН, глиоксаля ОНССНО, глиоксалевой кислоты ОНССООН и щавелевой кислоты; окисление молекулярным кислородом приводит к пероксидам, формальдегиду. муравьиной кислоте.
В промышленности этиленгликоль получают гидратацией этиленоксида. Процесс проводят при 130-150 °С и давлении 1,5-2 МПа при соотношении этиленоксид : вода (1:8)-(1:15). В качестве побочных продуктов образуются ди-, три- и полигликоли. Выход последних повышается при увеличении доли этиленоксида. В присутствии кислоты и щелочи скорость реакции возрастает, но возникает проблема коррозии оборудования и очистки этиленгликоля. Как правило, производство этиленгликоля объединяют с производством этиленоксида; при этом используют очищенный товарный этиленоксид или 9-12%-ный раствор, что снижает себестоимость этиленгликоля, но ухудшает его качество.
Выпускают этиленгликоль двух марок: волоконный и антифризный; для первого предъявляют очень жесткие требования к содержанию примесей альдегидов (поглощение в УФ области при 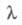 275 нм должно составлять не менее 95-97%).
275 нм должно составлять не менее 95-97%).
Первое промышленное производство этиленгликоля основывалось на гидролизе дихлорэтана водным раствором соды при 200 °С и давлении 10 МПа:
СlСН2СН2Сl + Na2CO3 + Н2О  НОСН2СН2ОН + 2NaCl + CO2
НОСН2СН2ОН + 2NaCl + CO2
Этиленгликоль может быть получен взаимодействием этиленоксида с СО2 при температуре 80-120 °С и давлении 2-5 МПа в присутствии галогенидов щелочных металлов, аммония или аминов с послед. гидратацией образующегося этиленкарбоната:
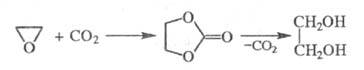
Этот метод позволяет использовать водный раствор этиленоксида (1:1), выход 97-98%.
Этиленгликоль образуется также при ацетоксилировании этилена с послед. гидролизом моно- и диацетатов этиленгликоль(кат.- хлориды Pd, Li, нитраты Fe, Ni); недостаток метода – высокая коррозионность среды, трудность отделения солей и продуктов реакции, необходимость регенерации катализатора.
При уменьшении добычи нефти и резком увеличении стоимости этилена представляют интерес методы синтеза этиленгликоля из альтернативного сырья: синтез-газа, метанола, СО и воды при температуре 200 °С и давлении 70 МПа либо в жидкой фазе при 40 МПа в присутствии оксидных медно-магниевых или родиевых катализаторов; из СО и Н2 – через диэфиры щавелевой кислоты.
Этиленгликоль применяют в химической, текстильной, автомобильной, авиационной, электротехнической промышленности; 41-45% мирового производства этиленгликоль используется для получения синтетических полиэфирных волокон и пленок,
40% – в производстве антифризов. Этиленгликоль применяют также в производстве гидравлической и закалочных жидкостей, полиуретанов, алкидных смол и др.
Этиленгликоль токсичен при попадании внутрь, действует на центральную нервную систему и почки; смертельная доза 1,4 г/кг. ПДК в воздухе рабочей зоны 5 мг/м 3 .
Этиленгликоль – горючая жидкость. Температура вспышки в открытом тигле 120 °С, температура самовоспламенения 380 °С, КПВ в воздухе: нижний 3,8, верхний 6,4% (по объему). Температурные пределы воспламенения: нижний 112 °С, верхний 124 °С.



